L’impact des pénuries de médicaments
Dans la deuxième partie de notre série sur la composition 503A, nous passons en revue l’état actuel de la composition de certains médicaments qui figurent sur la liste des pénuries, la composition «essentiellement une copie», ainsi que la composition de peptides, DTE, sémaglutide, β lactames, suspension d’ibuprofène, et bHRT. Nous explorerons également le projet de loi qui vise à combler les lacunes réglementaires.
Les directives temporaires de la FDA pour la composition 503A des médicaments en pénurie étaient censées être temporaires, uniquement pour les patients hospitalisés, et retirées une fois le COVID-19 terminé.1
Crédit : Polina – stock.adobe.com

Les directives stipulent que les préparateurs 503A sont autorisés à préparer un médicament qui est “essentiellement une copie d’un médicament disponible dans le commerce” ou peut fournir un médicament à un hôpital sans ordonnance spécifique au patient si les conditions sont remplies.
Le médicament doit figurer sur une liste de produits utilisés pour les patients hospitalisés. La liste, mise à jour pour la dernière fois en décembre 2021, comprend une douzaine de médicaments. Il convient de noter que les 503A qui composent ces médicaments sont soumis à des exigences supplémentaires, telles que le signalement des événements indésirables liés aux médicaments dans les 15 jours et l’envoi d’une notification au conseil de pharmacie de l’État indiquant qu’ils préparent ces médicaments spécifiques.
La liste de pénurie FDA 506 (E) est une liste beaucoup plus longue et en constante évolution de médicaments en pénurie. La disposition de 503A qui s’applique à la composition d’un produit médicamenteux qui est “essentiellement une copie d’un médicament disponible dans le commerce” ne s’applique pas à la composition d’un médicament figurant sur la liste des pénuries, car la FDA ne considère pas les médicaments figurant sur la liste comme étant “disponibles dans le commerce”. ”
Bien que ces médicaments puissent être composés par une pharmacie de préparation 503A, ils doivent être conformes à une ordonnance spécifique au patient. La législation proposée comblerait le vide réglementaire pour la préparation des médicaments en pénurie par des préparateurs 503A qui ne sont pas spécifiques au patient et élargirait la liste pour inclure non seulement la liste des pénuries de la FDA, mais également la liste des pénuries de l’ASHP, qui est plus locale/régionale.2
La législation obligerait les prescripteurs à indiquer qu’ils ne peuvent pas obtenir le composé d’un établissement 503B et exigerait en outre la déclaration des effets indésirables des médicaments.
Une fois que ces médicaments ne figurent plus sur la liste des pénuries, il y a une période de grâce de 60 jours pour la préparation où la FDA a indiqué qu’elle exercera son pouvoir discrétionnaire d’application. Cependant, ce délai de grâce ne s’applique qu’aux établissements 503B où des commandes importantes peuvent être en cours lorsque le médicament est retiré de la liste des pénuries. Il n’y a pas de tel langage de période de grâce pour les pharmacies de préparation 503A.
Composition de médicaments spécifiques en cas de pénurie
En janvier 2023, la FDA a publié une directive autorisant les installations de sous-traitance 503B à préparer temporairement la suspension d’ibuprofène à la concentration spécifique de 100 mg/5 mL.3 Mais les directives mentionnent dans la FAQ que les préparateurs 503A peuvent composer de l’acétaminophène et de l’ibuprofène si la préparation n’est pas effectuée “régulièrement ou en quantités excessives”, ce qui a été défini par la FDA dans une autre directive comme plus de 4 unités. En outre, toutes les autres conditions 503A devraient être remplies, par exemple, une prescription spécifique au patient.
En novembre 2022, la FDA a publié un guide décrivant sa politique discrétionnaire d’application pour la préparation de certains β-lactames, tels que la poudre d’amoxicilline pour suspension buvable, qui est en pénurie en raison d’une demande accrue.4 Certains fabricants ont imposé des limites à la quantité d’amoxicilline que les pharmacies peuvent acheter à un moment donné. Les directives traitent de l’incapacité des préparateurs 503A à préparer des versions composées en raison de l’exigence d’une “séparation complète et complète des produits non-β lactame”.
Les étapes détaillées pour éviter la contamination croisée, telles que la préparation de comprimés et de gélules au lieu de poudre en vrac, l’utilisation d’équipements dédiés ou jetables, et le mouillage par trituration pour réduire la poussière.
Des seringues sont préparées pour le sémaglutide et d’autres créatines jumelles (agonistes doubles des récepteurs GLP-1 et GIP) telles que le tirzepatide. Les deux médicaments figurent actuellement sur la liste des pénuries de la FDA en raison de leur popularité à la fois pour le diabète et la perte de poids, car une marque de sémaglutide est approuvée par la FDA pour la perte de poids et le tirzepatide est actuellement en attente de l’approbation de la FDA pour la perte de poids.
Étant donné que le sémaglutide est un médicament approuvé par la FDA et qu’il figure sur la liste des pénuries, il peut être composé par des préparateurs 503A pour des prescriptions spécifiques au patient. Le problème, cependant, est que souvent ce qui est composé n’est pas le sémaglutide, mais le sel de sodium qui n’est pas approuvé par la FDA, n’a pas de monographie USP/NF et ne figure pas sur la liste des vracs ni sur la liste des pénuries. Par conséquent, le sel de sodium ne peut être composé ni seul ni en combinaison avec des suppléments.
Peptides composés, DTE et bHRT
Depuis 2020, la FDA a imposé des restrictions sur la composition des peptides conformément à la loi sur la concurrence et l’innovation en matière de prix des produits biologiques (BPCIA).5 Les peptides contenant plus de 40 acides aminés sont considérés comme des protéines et des produits biologiques, qui ne peuvent être composés que si la pharmacie dispose d’une demande de licence de produits biologiques (BLA).
Étant donné que les préparateurs 503A ne peuvent pas acquérir de BLA, il leur est effectivement interdit de préparer des produits biologiques. Les peptides contenant moins de 40 acides aminés et les peptides approuvés par la FDA peuvent être combinés.
La plupart des peptides, même ceux qui ne sont pas considérés comme des produits biologiques avec moins de 40 acides aminés, ne répondent pas aux exigences légales en matière de préparation, c’est-à-dire la monographie USP/NF, l’ingrédient d’un médicament approuvé par la FDA ou sur la liste des produits en vrac. Certains sont approuvés par la FDA et peuvent être composés ; cependant, il est extrêmement important d’être certain que ce que l’on vous demande de composer entre dans la catégorie autorisée à composer. De plus, le mélange, la dilution et le reconditionnement sont autorisés.6
Il semble que l’interdiction de la composition de peptides soit appliquée de manière sélective, la FDA ciblant des doses élevées, des produits entraînant des effets indésirables ou vantant les indications du COVID-19. Il y a eu très peu de lettres d’avertissement concernant la composition de peptides depuis 2020.
Parce que l’extrait thyroïdien desséché (DTE) a une monographie USP/NF, les pharmacies 503A l’ont composé. La FDA a récemment classé le DTE comme un produit biologique, ce qui signifie qu’il ne peut pas être composé, et ils ont envoyé des lettres à cet effet à l’Association nationale des conseils de pharmacie (NABP).7
La classification était basée sur l’ingrédient inactif thyroglobine; cependant, un produit médicamenteux qui contient une protéine uniquement comme ingrédient inactif n’est pas un produit biologique selon la définition statutaire d’un produit biologique (p. ex., les produits médicamenteux formulés avec des traces d’albumine humaine ne sont pas considérés comme des produits biologiques). Un produit biologique ne peut pas être classé sur la base d’un ingrédient inactif qui n’apparaît même pas dans la monographie USP ou sur l’étiquetage du produit commercial.
Bien qu’il semble que le processus d’avis et de commentaires proscrit par la loi sur les procédures administratives ait pu être contourné ici, la FDA a récemment déclaré qu’elle exercerait son pouvoir discrétionnaire d’application pour la composition DTE.
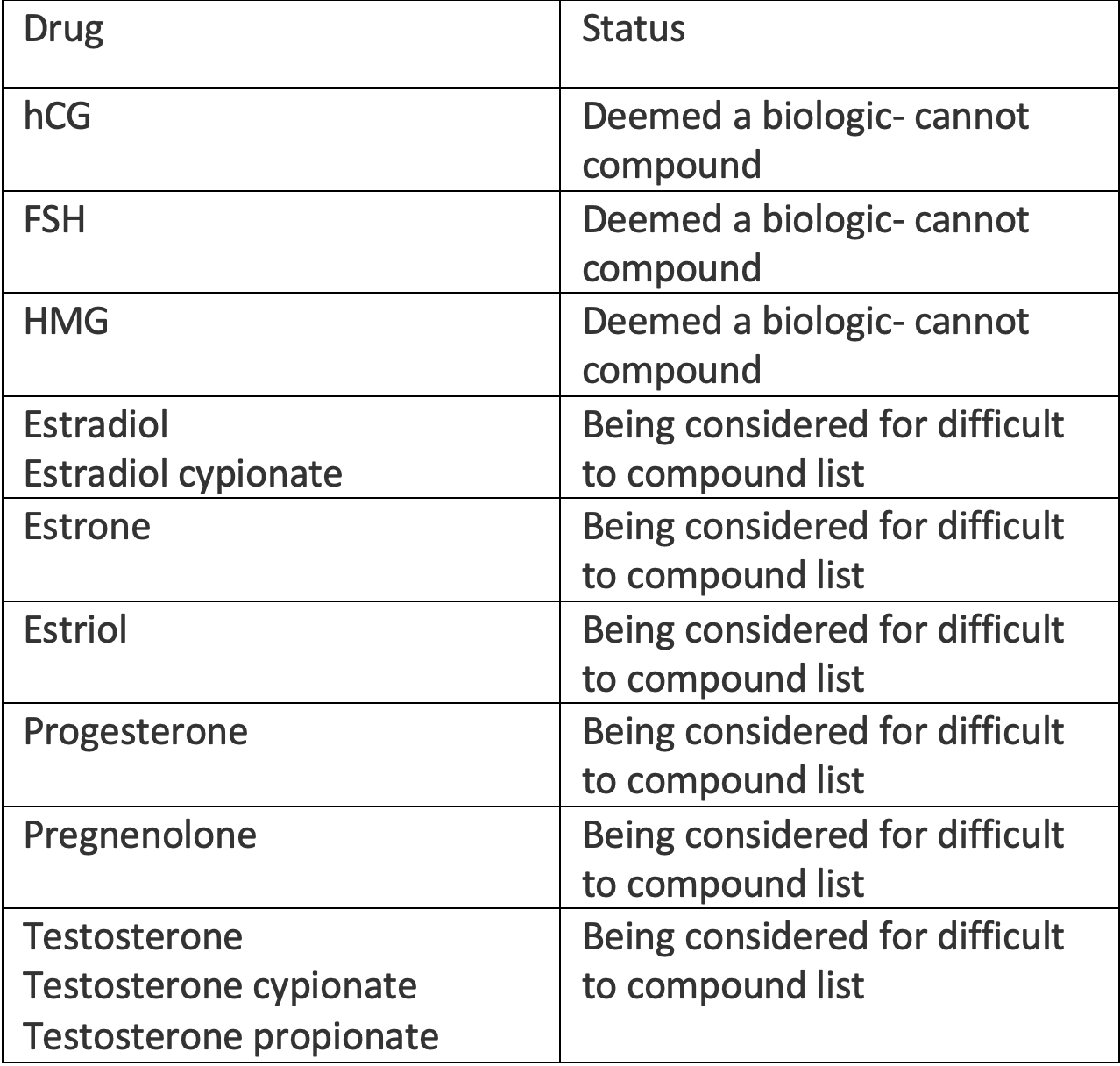
La FDA envisage actuellement de placer 11 hormones utilisées dans la thérapie hormonale bio-identique composée (cBHT) sur une «liste difficile à composer», interdisant ainsi la composition de ces ingrédients.8 Les hormones récemment classées comme produits biologiques sont déjà interdites de composition, ce qui comprend des composés de fertilité tels que HCG, FSH et HMG.
La FDA a tenté en vain en 2008 et 2018 d’interdire le bHRT. Les efforts de la base pour préserver l’accès des patients au bHRT impliquent une approche législative, réglementaire et juridique à plusieurs volets. Le Tableau présente la liste des hormones dont la composition serait interdite.
Tableau. Statut de la composition hormonale
Il existe certainement de nombreux développements juridiques et réglementaires qui présentent des opportunités et des défis pour les préparateurs en pharmacie. De toute évidence, le paysage de la préparation de médicaments en pharmacie change souvent.
A propos de l’auteur
Martha M. Rumore, PharmD, Esq, MS, LLM, FAPhA, est avocate principale chez Frier Levitt.
Les références
1. Orientations pour l’industrie. Politique temporaire pour 503A pour les patients hospitalisés pendant l’urgence COVID. Centre d’évaluation et de recherche sur les médicaments (CDER). FDA. 21 mai 2021.
2. HR 167. Patient Access to Urgent Use Pharmacy Compounding Act of 2023. (introduit pour la première fois en 2021 et réintroduit le 9 janvier 2023).
3. Conseils pour l’industrie. Composition de certains produits de suspension orale d’ibuprofène en vertu de l’article 503B de la loi fédérale sur les aliments, les médicaments et les cosmétiques. CDER. FDA. janvier 2023.
4. Lignes directrices à effet immédiat pour l’industrie. Composition de certains produits bêta-lactamines en pénurie en vertu de l’article 503A de la loi fédérale sur les aliments, les médicaments et les cosmétiques. CDER. FDA. nov. 2022.
5. Pub. L. 111-148.
6. Directives de la FDA. Mélange, dilution ou reconditionnement de produits biologiques en dehors du champ d’application d’une BLA approuvée. CDER. FDA. janv. 2018.
7. Lettre de Shannon Glueck, chef de division, Bureau de la préparation et de la conformité, FDA à Lemrey “Al” Carter, directeur exécutif, NABP, datée du 16 septembre 2022.
8. La « liste des composés difficiles à composer » est une liste de produits pharmaceutiques qui présentent des difficultés démontrables pour la composition basée sur 6 critères développés par la FDA.
